원자의 구성 입자와 성질
| 구성 입자 | 상대적 질량 | 실제 전하(C) | 상대적 전하 | |
| 원자핵 | 양성자(p) | 1 | ┼1.6×10-19 | ┼1 |
| 중성자(n) | 1 | 0 | 0 | |
| 전자(e-) | 1/1837 | ─1.6×10-19 | ─1 | |
원자의 구성 입자와 성질
* 전자 껍질 : 전자가 핵의 주위에서 운동하면서 차지하는 공간이다.
* 전자 배치 : 원자핵과 가장 가까운 껍질에서부터 배치된다.
* 최외각 전자 : 전자 배치에서 가장 바깥쪽 전자 껍질에 들어 있는 전자를 최외각 전자라고 한다. 최외각 전자의 수가 같으면 같은 족에 속하는 원소이고, 화학적 성질이 비슷하다. 즉, 원자의 화학적 성질을 지배하는 요인은 최외각 전자이다.
팔전자 규칙(옥텟 규칙)
* 가장 바깥쪽 전자 껍질에 채워지는 전자의 최대수는 8개이며, 최외각 전자 수가8개가 되면 안정하게 된다는 규칙이다.
* 최외각 전자가 8개가 되지 못하는 원자는 다른 원자와의 화학 결합을 통하여 전자를 잃거나, 얻거나, 공유하는 방식으로 옥텟을 이루게 된다.
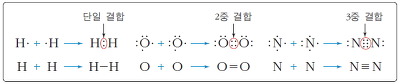
공유 결합
* 공유 결합의 형성 : 비금속 원자들이 최외각 전자의 일부를 내어 놓아 전자쌍을 이루고 이 전자쌍을 공유함으로써 안정한 옥텟을 형성하는 결합
* 2중 결합과 3중 결합 : 원자들이 두 쌍의 전자쌍을 공유하거나, 세 쌍의 전자쌍을 공유하기도 하는데, 이를 각각 2중 결합, 3중 결합이라고 한다.
* 공유 결합 에너지 : 기체 상태의 분자에서 두 원자 사이의 공유 결합 1몰을 끊어서 중성 원자로 만드는 데 필요한 에너지를 말한다. 원자 사이의 공유 결합을 통해 만들어진 분자는 공유 결합 에너지의 합만큼 원자보다 안정하다. 따라서 분자에 분자의 공유 결합 에너지보다 큰 에너지가 주어지지 않는다면 원자 상태로 돌아가지 않고, 결합을 통한 분자 상태를 유지하게 된다. 즉, 공유 결합 에너지의 값이 클수록 결합이 강하다.
우주를 구성하는 물질들
우주를 구성하는 대부분의 원소는 H, O, C, N 등의 비금속 원자이다. 따라서 주로 이들 간의 공유 결합을 통하여 우주를 구성하는 물질이 만들어진다.
| 종류 | 질량비 | 개수비 |
| H | 73.96953 | 92.34612 |
| He | 24.02258 | 7.497655 |
| O | 1.040979 | 0.081225 |
| C | 0.460433 | 0.047902 |
| Ne | 0.134126 | 0.100469 |
| Fe | 0.109103 | 0.002522 |
| N | 0.09609 | 0.008569 |
반응 속도
* 반응 속도는 화학 반응이 빠르게 또는 느리게 일어나는 정도를 말하며, 화학 반응이 일어날 때 단위 시간당 감소한 반응 물질의 양이나 증가한 생성 물질의 양으로 나타낸다.
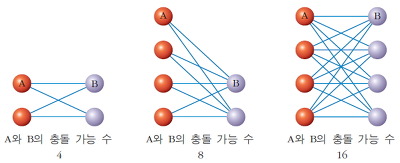
* 화학 반응이 일어나기 위해서는 분자들 간에 충돌이 있어야 한다. 따라서 충돌 횟수가 증가하면 반응 속도는 빨라진다.
* 반응 속도에 영향을 미치는 요인
농도와 반응 속도
* 반응 물질의 농도가 증가하면 단위 부피 속에 들어 있는 입자 수가 증가하므로, 충돌 횟수가 증가하여 반응 속도가 빨라진다.
* 기체 간의 반응에서는 기체의 압력이 커지면 부피가 감소하므로 농도가 증가하는 것과 같은 효과가 나타난다.
(예)철은 건조한 곳보다 습한 곳에서 더 빨리 녹슨다.
아연은 묽은 염산보다 진한 염산 속에 넣었을 때 더 빠르게 반응한다.
표면적과 반응 속도
고체의 표면적이 커지면 반응 물질 간의 접촉 면적이 커지게 되어 충돌 횟수가 증가하게 되므로 반응 속도가 빨라진다.
(예) 알약보다 가루약이 효과가 더 빠르다.
탄광 내부나 곡물 창고 안에서 화기를 사용하면 큰 폭발이 일어난다.
온도와 반응 속도
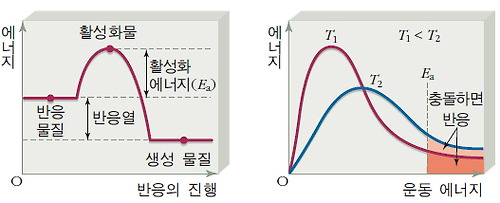
* 활성화 에너지: 반응 물질이 반응을 일으키는 데 필요한 최소한의 에너지로, 활성화 에너지가 클수록 반응 속도가 느리고 활성화 에너지가 작을수록 반응 속도가 빠르다.
* 활성화 에너지 이상의 에너지를 가진 입자들이 유효 충돌해야 반응이 일어날 수 있으므로, 온도가 높아져서 활성화 에너지보다 큰 에너지를 갖는 입자 수가 증가하면 반응 속도가 빨라진다.
(예) 공기 중의 질소와 산소는 상온에서는 반응하지 않으나 고온에서 반응하여 질소 산화물을 생성한다.
촉매와 반응 속도
* 촉매 : 화학 반응에서 자신은 변하지 않으면서 반응 속도를 변화시키는 물질이다.
* 촉매는 활성화 에너지를 변화시켜서 반응 속도를 변화시킨다.
(예) 과산화수소에 이산화망간을 넣어 주면 산소가 빨리 발생한다.
된장이나 막걸리를 만드는 데 곰팡이나 누룩을 이용한다.
관련문제
- 1. ㄱ, ㄴ
- 2. ㄷ, ㄹ
- 3. ㄱ, ㄷ, ㄹ
- 4. ㄴ, ㄷ, ㄹ
- 5. ㄱ, ㄴ, ㄷ, ㄹ
- 정답
- 3
- 해설
- 고체나 액체의 반응에서는 압력의 영향을 거의 받지 않는다.
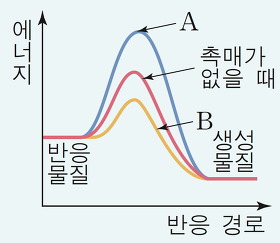
- 1. A, B는 같은 물질의 반응을 나타낸 것이다.
- 2. 활성화 에너지의 크기는 A가 B보다 크다.
- 3. A는 정촉매를 사용했을 때의 반응이다.
- 4. 반응 속도는 A보다 B가 더 빠르다.
- 5. 반응 물질보다 생성 물질의 에너지가 작다.
- 정답
- 3
- 해설
- A는 활성화 에너지가 커지는 경우로 부촉매를 사용했을 때이고, B는 정촉매를 사용하여 활성화 에너지를 작게 한 경우이다. 따라서 반응 속도는 A보다 B가 더 빠르다.
'사는 이야기 > 과학사전' 카테고리의 다른 글
| 아세틸CoA 생성과 TCA회로 (0) | 2015.10.08 |
|---|---|
| 망간 (0) | 2015.10.03 |
| 맛 세포, 혀 위치 (0) | 2015.10.02 |
| 태양의 1년 움직임…남극 ‘아날렘마’ 포착 (0) | 2015.10.01 |
| 산소가 지구 대기와 생물에게 끼친 영향 (환원형 대기) (0) | 2015.09.18 |