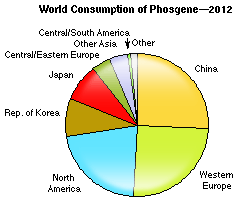
헨리의 법칙[다른 표기 언어 Henry's law ] 요약: 액체에 용해된 기체의 무게는 기체 압력에 비례한다는 법칙. 1803년 영국의 의사이며 화학자인 윌리엄 헨리가 처음으로 공식화한 이 법칙은 묽은 용액과 낮은 기체압력에 대해서만 적용된다. 윌리엄 헨리 헨리의 법칙(Henry's law)은 1803년 윌리엄 헨리가 발견한 기체 법칙이다. ⓒ Stanmar/Wikipedia | 퍼블릭 도메인 매우 묽은 용액에서 용질 분자의 주변에는(거의 예외 없이) 용매 분자만이 존재하며, 특정 용질 분자가 기체상으로 달아날 확률은 용질 분자의 총농도에 의존하지 않는다. 이때 용질 분자가 달아나는 속도는 용액에서의 농도에 비례하며, 용질은 돌아오는 속도와 달아나는 속도가 같아질 때까지 기체에 축적된다. 기체가 아주 ..