목차
용해, 용매, 용질
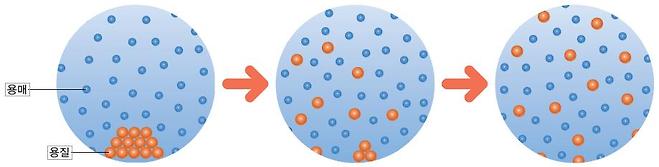
우리는 일상생활에서 많은 물질을 물에 녹여서 사용한다. 예를 들어 소금이나 설탕과 같은 물질을 음식에 넣으면 물에 녹아서 맛을 낸다.
설탕이 물에 녹으면 눈에 보이지 않을 정도의 작은 알갱이로 나뉘어 물에 고르게 섞인다. 이처럼 어떤 물질이 다른 물질에 고르게 섞여 들어가는 현상을 용해라고 한다. 이때 설탕과 같이 녹는 물질을 용질이라고 하고, 물과 같이 녹이는 물질을 용매라고 한다.
설탕물과 같이 용매와 용질이 균일하게 섞여 있는 것을 용액이라고 한다. 특히, 용매가 물인 용액을 수용액이라고 한다.
설탕(용질) + 물(용매) →(용해) 설탕물(용액)
※ 용매와 용질의 구분
설탕물과 같이 액체에 고체가 녹아 있는 용액은 용매와 용질을 쉽게 구분할 수 있다. 그러나 같은 상태의 용매와 용질이 섞여 있는 경우에는 용액을 구성하는 성분 중에서 많은 양으로 존재하는 성분을 용매라고 하고, 적은 양으로 존재하는 성분을 용질이라고 한다. 에탄올과 물이 섞여 있을 때, 에탄올이 물보다 많을 때에는 에탄올이 용매, 물이 용질이 되고, 물이 에탄올 보다 많을 때에는 물이 용매, 에탄올이 용질이 된다. 공기는 여러 가지 기체의 혼합물인 기체 용액으로 가장 많은 양을 차지하는 질소가 용매이고, 나머지 산소나 이산화 탄소와 같은 기체들은 용질이다.
물질이 용매에 용해되는 정도
보고 생각하기
물에 잘 녹는 물질이 있는 반면, 물에 잘 녹지 않는 물질도 있다. 참기름이나 고기의 기름은 물에 녹지 않고 물 위에 뜬다. 물질이 용매에 용해 되는 정도에는 어떤 차이가 있을까?
다음 (가)는 4개의 시험관에 물을 넣은 다음, 설탕, 나프탈렌, 염화 나트륨, 식용유를 각각 한 숟가락씩 넣고 유리 막대로 저어 준 것이다. (나)는 물 대신 헥세인을 이용하여 (가)의 과정을 반복한 것이다.
* 헥세인 : 물과 섞이지 않는 액체이며, 기름 성분을 녹이는 데 이용되는 용매이다.
1. 물에 잘 녹는 물질과 잘 녹지 않는 물질은 각각 무엇인가?
정답 :* 물에 잘 녹는 물질 : 설탕, 염화 나트륨
* 물에 잘 녹지 않는 물질 : 나프탈렌, 식용유
2. 헥세인에 잘 녹는 물질과 잘 녹지 않는 물질은 각각 무엇인가?
정답 :* 헥세인에 잘 녹는 물질: 나프탈렌, 식용유
* 헥세인에 잘 녹지 않는 물질: 설탕, 염화 나트륨
설탕과 염화 나트륨은 물에 잘 녹지만 헥세인에는 잘 녹지 않는다. 반면에 나프탈렌과 식용유는 물에 잘 녹지 않지만 헥세인에는 잘 녹는다. 이것은 물질이 용매에 용해되는 정도가 다르기 때문이다.
용해도
물이 들어 있는 비커에 염화 나트륨을 한두 숟가락 넣고 저어 주면 모두 녹는다. 그런데 염화 나트륨을 조금씩 더 넣어 주면 어느 순간부터 염화 나트륨이 더 이상 녹지 않고 비커 바닥에 가라앉는다.
이처럼 용질이 용매에 더 이상 녹을 수 없을 정도로 최대한 녹아 있는 상태를 포화 상태라고 하며, 포화 상태의 용액을 포화 용액이라고 한다.
일정한 온도에서 용매 100 g에 최대한 녹을 수 있는 용질의 질량을 g수로 나타낸 것을 그 용질의 용해도라고 한다.
온도에 따른 물질의 용해도
탐구하기
| 준비물 | 질산 칼륨, 증류수, 약포지, 알코올램프, 삼발이, 쇠그물, 성냥, 온도계, 시험관, 비커, 전자저울, 약숟가락, 눈금실린더, 스탠드, 링, 스타이로폼 판지, 보안경, 실험용 고무장갑 |
| 과정 | 1. 증류수가 10 mL씩 들어 있는 4개의 시험관에 각각 4 g, 6 g, 11 g, 17 g의 질산 칼륨을 넣는다. 2. 과정 1의 시험관을 물중탕 장치에 넣고 온도계를 설치한 다음 서서히 가열한다. 3. 시험관 속의 질산 칼륨이 모두 녹았을 때의 온도를 측정하여 다음과 같은 결과를 얻었다. |
| 질산 칼륨의 양(g) | 4 | 6 | 11 | 17 |
| 질산 칼륨이 모두 녹았을 때의 온도(ºC) | 26 | 39.5 | 60 | 80 |
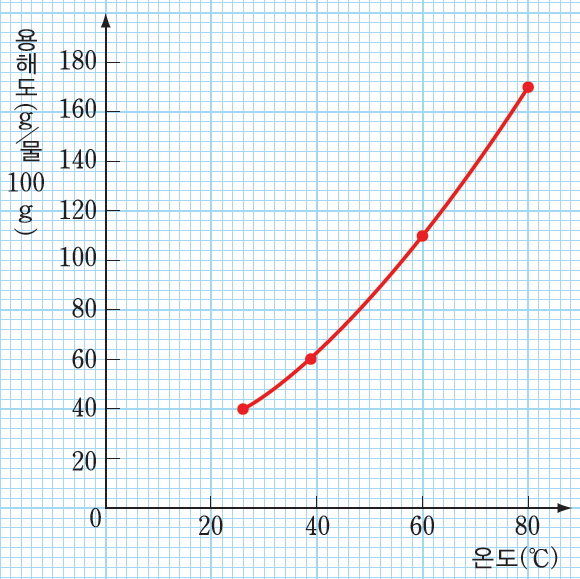
[ 결과 및 정리 ] 1. 실험 결과를 바탕으로 하여 각 온도에서 질산 칼륨의 용해도를 계산해 보자.
| 온도(ºC) | 26 | 39.5 | 60 | 80 |
| 질산 칼륨의 용해도(g/물 100g) | 40 | 60 | 110 | 170 |
2. 온도에 따른 질산 칼륨의 용해도를 그래프로 나타내 보자.
3. 질산 칼륨의 용해도는 온도에 따라 어떻게 변하는가?
정답 :온도가 높아질수록 질산 칼륨의 용해도는 증가한다.
온도에 따른 물질의 용해도
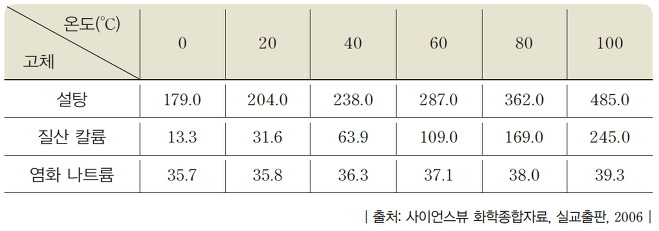
물질의 용해도는 온도에 따라 달라진다. 일반적으로 고체를 액체에 녹일 때에는 온도가 높아질수록 용해도가 증가한다.
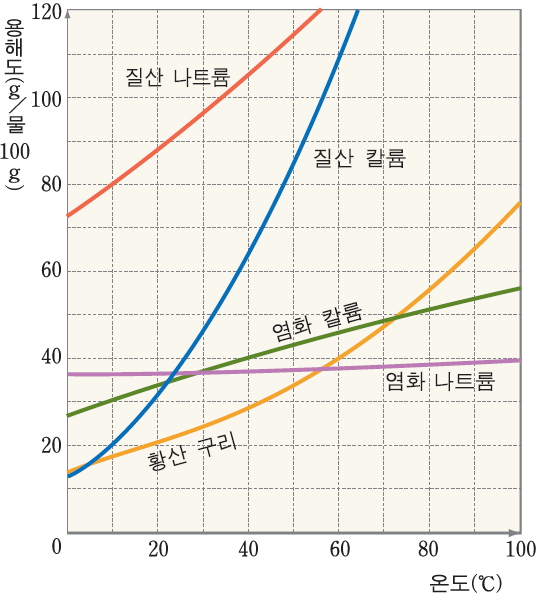
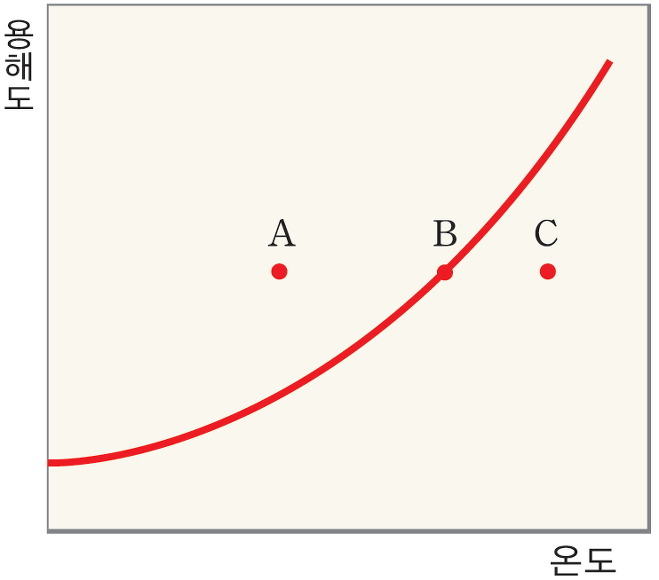
용해도는 물질의 종류에 따라 다르고 같은 물질이라도 온도에 따라 다르다. 그러나 같은 온도에서 용해도는 물질에 따라 고유한 값을 나타낸다. 일정한 온도에서 용해도를 이용하면 물질을 구별할 수 있다. 따라서 용해도는 물질의 특성이다. 온도에 따른 고체의 용해도를 나타낸 그래프를 용해도 곡선이라고 한다. 용해도 곡선을 보면 여러 가지 물질의 용해도가 온도에 따라 어떻게 변화 하는지를 쉽게 비교할 수 있고, 포화 용액을 냉각시킬 때 석출되는 용질의 양을 계산할 수 있다.
고체 상태의 물질뿐만 아니라 기체 상태의 물질도 물에 용해될 수 있다. 기체의 용해도가 온도와 압력에 따라 어떻게 달라지는지 알아보자.
기체의 용해도
높은 온도의 물에 들어 있는 시험관에서 기포가 많이 발생하는 것은 온도가 높을수록 기체의 용해도가 감소하기 때문이다. 또한, 마개가 없는 시험관에서 기포가 많이 발생하는 것은 압력이 작을수록 기체의 용해도가 감소하기 때문이다.
물에는 산소가 녹아 있어서 물고기가 물속에서 숨을 쉴 수 있다. 더운 여름철 어항 속의 금붕어가 수면 가까이 올라와서 입을 뻐끔거리는 때가 있다. 이것은 물의 온도가 높아지면 물에 녹아 있는 산소의 용해도가 감소하기 때문이다.
보고 생각하기
그림과 같이 시험관 A~D에 각각 사이다를 
* 온도에 따른 기포의 발생 : 50°C 정도의 물에 담긴 시험관 D의 사이다에서 기포가 가장 많이 발생하였다.
* 압력에 따른 기포의 발생 : 실온의 물에 담긴 2개의 시험관 중 마개가 없는 시험관 B의 사이다에서 기포가 많이 발생하였다.
기체의 용해도는 온도와 압력에 따라 어떻게 변하는가?
기체의 용해도는 온도가 낮을수록, 압력이 높을수록 증가한다.
※ 길잡이
* 사이다가 들어 있는 시험관을 고무마개로 막으면 발생하는 이산화 탄소가 시험관에 모이므로 압력이 높아진다.
* 사이다에서 기포가 발생하는 것은 물에 녹아 있던 이산화 탄소가 빠져나오기 때문이다.
잠깐 퀴즈
1. 물에 설탕이 녹을 때 설탕과 같이 녹는 물질을 ( ), 물과 같이 녹이는 물질을 ( )라고 한다.
정답 :용질, 용매
2. 온도가 높아질수록 기체의 용해도가 증가한다면 어떤 현상이 일어날지 상상해 보자.
예시 답안 | 이산화 탄소가 녹아 있는 탄산음료를 냉장고에 넣어 보관하여 온도를 낮춘 다음 마개를 열었을 때가 실온에서 보관한 다음 마개를 열었을 때보다 더 많은 양의 이산화 탄소가 발생할 것이다.
'사는 이야기 > 과학사전' 카테고리의 다른 글
| 외호흡과 내호흡 (0) | 2017.04.15 |
|---|---|
| 호흡계와 순환계를 이용한 기체의 교환 (0) | 2017.04.15 |
| 크로마토그래피 이용한 분리 (0) | 2017.04.15 |
| 용해도차이를 이용한 분리(분별결정) (0) | 2017.04.15 |
| 기압과기온의 상관관계 (0) | 2017.04.15 |