산화제와 환원제
[ oxidant and reductant ]
산화 환원 반응에서 산화수가 증가하는 원소가 있으면 반드시 산화수가 감소하는 원소가 있다. 즉, 어떤 물질이 산화되면 반드시 다른 물질이 환원된다. 이때 자신이 환원되면서 다른 물질을 산화시키는 물질을 산화제라고 하고, 자신이 산화되면서 다른 물질을 환원시키는 물질을 환원제라고 한다.
홑원소 물질인 경우 대체로 금속 원소(Na, Mg, Al, Zn)는 전기음성도가 작아 전자를 잃기 쉬우므로 환원제로, 비금속 원소(F2, Cl2, Br2, I2, O2)는 전기음성도가 커서 전자를 얻기 쉬우므로 산화제로 작용한다. 그러나 같은 물질이라도 반응하는 상대에 따라 산화제가 될 수도 있고 환원제가 될 수도 있다. 여기서는 오존(O3)과 이산화 황(SO2)처럼 같은 루이스 구조를 가지는 경우에 왜 오존은 산화제로, 이산화 황은 환원제로 작용하는지를 통해서 산화제와 환원제의 특성과 원리를 알아본다.
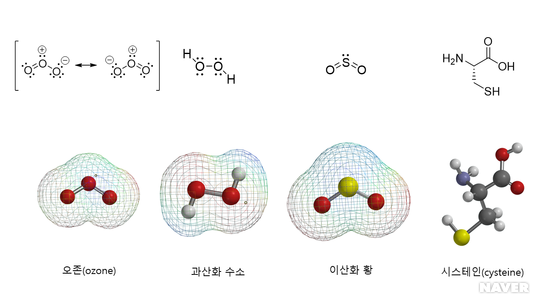
산화제로 작용하는 오존과 과산화 수소, 환원제로 작용하는 이산화 황과 시스테인의 화학 구조 (출처:대한화학회)
목차
1.산화제인 오존
산소(O2)도 물론 산화제이지만 오존(O3)은 산소보다 강한 산화제이다. 오존은 어떻게 생기고 왜 산화제로 작용할까? 지구 대기의 상층부에는 오존층이 있어서 태양의 자외선을 차단하는 역할을 한다. 이중 결합을 가진 산소 분자는 자외선에 의해 분해되어 산소 라디칼, 즉 산소 원자로 바뀌는데, 산소 원자는 최외각 전자가 6개라서 두 개의 전자가 필요하다. 그런데 주위에 풍부한 산소 분자에서 모든 산소 원자는 각각 두 쌍의 비공유 전자쌍을 가진다. 그래서 산소 분자와 산소 원자가 만나면 산소 원자는 산소 분자의 비공유 전자쌍을 이용해서 쉽게 옥텟 규칙을 만족시키고 단일 결합을 만든다.
단일 결합에 사용되는 두 개의 전자가 양쪽 원자에서 각각 하나씩 오지 않고, 한쪽에서 일방적으로 오는 결합을 배위 결합이라고 하는데 오존은 산소 분자와 산소 원자 사이의 배위 결합으로 이루어진 산소의 동소체(allotrope)인 것이다. 그런데 쉽게 얻은 것은 쉽게 잃게 마련이듯이 오존은 쉽게 산소 분자와 산소 원자로 분해된다. 다시 말하면 오존은 산소 분자보다 불안정하다. 오존은 전기음성도가 높은 산소 원자 3개가 결합해서 서로 전자를 끌어가려고 하는 상황인데, 그중 하나가 다른 산소에서 일방적으로 전자쌍을 받고 있다면 오존은 상당히 불안정할 것이다. 그래서 오존은 쉽게 산소 라디칼을 내놓는데, 이 산소 라디칼은 주위의 물질을 공격해서 산화시킨다. 그래서 오존은 강한 산화제로 작용하는 것이다.
산화제인 과산화 수소
2.과산화 수소(hydrogen peroxide, H2O2)에서 두 산소는 HO-OH 식으로 단일 결합을 하고 있다. 이 경우에 두 산소 원자는 각각 두 개의 비공유 전자쌍을 가진다. 그래서 H2O2에서는 4개의 비공유 전자쌍이 가까운 거리에서 반발하고 불안정하다. 뿐만 아니라 각각의 산소는 결합한 수소로부터 전자를 끌어당기기 때문에 전체적으로 수소의 양전하, 산소의 음전하, 산소의 음전하, 수소의 양전하가 +--+ 식의 배치되고 중심부에서 음전하 사이의 반발이 일어나서 전체적으로 불안정한 구조가 된다. 그래서 H2O2에서 O 원자 하나가 빠져나오고 안정한 물로 바뀌는 반응이 쉽게 일어난다. 그리고 이때 빠져나온 O 원자는 오존의 경우와 마찬가지로 산화력을 나타낸다. 상처가 났을 때 과산화 수소 용액을 바르면 즉각적으로 격렬한 반응이 일어나면서 소독 효과가 나타나는 것을 볼 수 있다.
3.환원제인 이산화 황(SO2)
주기율표에서 산소와 황은 같은 족에 속한다. 그래서 O2와 같은 루이스 구조를 가지고 이중 결합으로 이루어진 SO 분자가 가능하다. 그런데 황은 산소보다 원자 반지름이 상당히 크기 때문에 이중 결합이 효과적으로 이루어지지 않고 결과적으로 SO는 불안정하고, SO의 표준생성엔탈피는 –5 kJ/mol에 불과하다. 한편 O2에 산소 원자가 결합하면 O3가 되듯이 SO에 산소 원자가 결합하면 SO2가 되는데, SO2는 표준 생성 엔탈피가 –197 kJ/mol로 상당히 안정하다. O3보다는 O2가 안정한데 반해, SO보다 SO2가 안정한 것이다. 그래서 공기 중에서 황을 태우면 SO는 거의 찾아볼 수 없고, 모든 황은 일단 SO2로 바뀐다. SO2가 안정하면서도 환원력을 가지는 이유를 이해하려면 SO2의 루이스 구조를 살펴보아야 한다. S와 O는 최외각 전자 수가 같기 때문에 SO2에서 세 원자가 S-O-O 또는 O-S-O 중 어느 방식으로 결합했다 하더라도 루이스 구조를 그릴 수 있다. 그러나 S-O-O에서는 전기음성도가 높은 산소끼리 결합해서 불리한 반면 O-S-O에서는 전기음성도가 높은 산소가 양쪽에서 전기음성도가 상대적으로 낮은 황으로부터 전자를 끌어당기기 때문에 보다 안정하다. 그래서 SO2의 실제 구조는 S-O-O가 아니라 O-S-O이다. 그런데 O-S-O에서 황은 두 쌍의 비공유 전자쌍을 가지고 있다. 그래서 주위에 산소가 풍부하면 산소 라디칼은 황의 비공유 전자쌍을 이용해서 SO2와 결합하여 2SO2 + O2 → 2SO3 반응을 통해 삼산화 황으로 바뀐다. 이때 황의 산화수는 +4에서 +6으로 증가하면서 황은 산화되고, SO2는 환원제로 작용한다. 고대부터 이산화 황의 환원력은 잘 알려졌다. 그래서 성전처럼 정결을 요하는 장소에서는 황을 태웠다고 한다. 대부분의 부패는 산화의 결과이기 때문에 환원제를 사용해서 산화와 부패를 방지한 것이다. 다시 말하면 이산화 황은 항산화제 효과를 나타낸다. 그래서 이산화 황은 장기 저장을 요하는 식품 등에서 항산화제로 널리 사용된다. 한편 SO3는 물에 녹으면 황산(H2SO4)이 된다.
4.환원제인 싸이올
유기 화합물 중에서 에탄올(C2H5OH)처럼 탄소에 –OH(hydroxyl)기가 결합한 화합물을 알코올이라고 하듯이, 탄소에 –SH(sulfhydryl)기가 결합한 화합물을 싸이올(thiol)이라고 부른다. -SH기를 가진 중요한 화합물에는 아미노산의 일종인 시스테인(cysteine)이 있다. –SH기 둘이 만나면 쉽게 –S-S- 식으로 이황화 결합(disulfide bond)을 만든다. 이황화 결합은 단백질의 3차원 구조를 유지하는데 중요한 역할을 한다. 그런데 –SH기가 –S-S- 결합으로 바뀌는 과정에서 수소가 빠져나가기 때문에 이 변화는 산화에 해당한다. 그렇다면 싸이올은 환원제로 작용하는 셈이다. 싸이올은 특히 생체 내에서 환원제로 중요한 역할을 담당한다. 이러한 싸이올의 환원 작용이 일어나기 위해서는 –S-S- 결합이 안정해야 할 것이다. 그런데 과산화 수소에서 보았듯이 –O-O- 결합은 불안정하다. 산소와 황은 같은 족에 속하는데 왜 –O-O- 결합은 불안정하고 –S-S- 결합은 안정할까? 산소는 수소 또는 탄소보다 전기음성도가 높아서 H-O-O-H 또는 –C-O-O-C-에서 음전하를 띠게 되고, 음정하 사이의 반발 때문에 –O-O- 결합은 불안정하게 된다. 그러나 황은 전기음성도가 2.6으로 산소의 전기음성도 3.5보다는 낮고 탄소의 전기음성도 2.5와 비슷해서 –C-S-S-C-는 안정한 –S-S- 결합을 가지는 것이다.
[네이버 지식백과] 산화제와 환원제 [oxidant and reductant] (화학백과)
'사는 이야기 > 위험물기능장' 카테고리의 다른 글
| 장뇌 (0) | 2021.02.03 |
|---|---|
| 염화칼슘[CaCl2] (0) | 2021.02.03 |
| 은거울빈응(은경반응) (0) | 2021.02.03 |
| 2류 위험물인 인화성고체에 대하여. . . (0) | 2021.02.02 |
| 위험물 분류표 (0) | 2021.02.01 |