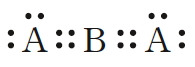목차
공유 결합
이온 결합은 원자들이 전자를 잃거나 얻을 때 형성된다. 그런데 어떤 원자들은 다른 원자들과 전자를 공유함으로써 비활성 기체와 같이 안정된 전자 배치를 이루면서 옥텟 규칙을 만족시킨다. 2개 이상의 원자들이 전자쌍을 공유하면서 형성되는 화학 결합을 공유결합이라고 한다.
그림 Ⅲ-20과 같이 수소 분자의 형성 과정에서 2개의 수소 원자는 각각 1개의 전자를 내놓아 만든 전자쌍을 동시에 공유함으로써 헬륨과 같은 안정한 전자 배치를 가지게 된다.
수소처럼 공유 결합에 의해 만들어진 물질을 공유 결합 화합물 또는 공유 결합 물질이라고 한다. 물 분자는 수소 원자 2개와 산소 원자 1개로 구성되어 있으며, 그림 Ⅲ-21과 같이 산소 원자 1개가 수소 원자 2개와 전자 1쌍씩을 공유함으로써 옥텟 규칙을 따르고 있다.
우리 생활 주변에서 쉽게 접할 수 있는 메테인(CH4), 암모니아(NH3), 에탄올(C2H5OH), 포도당(C6H12O6) 등은 모두 공유 결합으로 이루어진 화합물이며, 녹말, 단백질, DNA 등과 같은 고분자 물질도 공유 결합으로 이루어진 화합물이다.
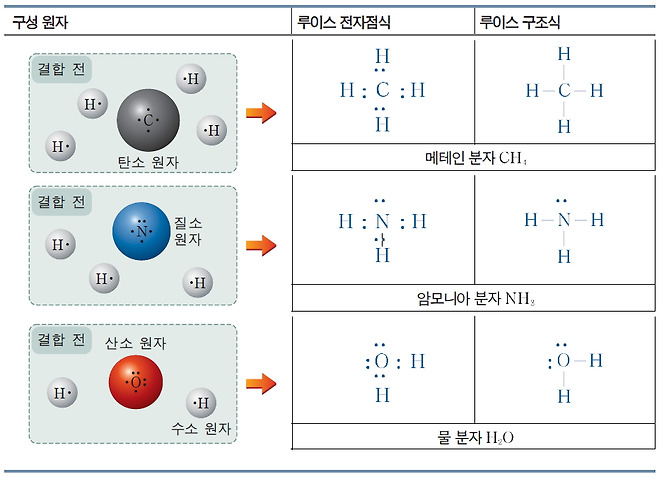
루이스는 화학 결합을 나타내기 위하여 원자들의 원자가 전자를 점으로 나타내는 방법을 이용하였는데, 이것을 루이스 전자점식이라고 한다.
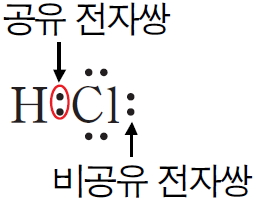
원자의 최외각 전자 껍질에 존재하는 원자가 전자 중에서 쌍을 이루지 않은 전자를 홀전자라고 하는데, 원자들이 공유 결합을 할 때에는 홀전자들이 전자쌍을 이루어 공유 전자쌍을 만든다. 전자가 쌍을 이루고 있으나 공유 결합에 참여하지 않은 전자쌍은 비공유 전자쌍이라고 한다.
공유 결합 분자의 전자 배치를 간편하게 나타내기 위해서 공유 전자쌍은 결합선(—)으로 나타내고, 비공유 전자쌍은 1쌍의 점으로 나타내거나 생략하기도 하는데, 이것을 루이스 구조식이라고 한다.
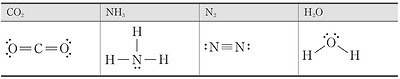
메테인과 암모니아, 물 분자의 루이스 전자점식과 루이스 구조식
다음 원자들이 공유 결합을 형성하여 만들어지는 메테인(CH4), 암모니아(NH3), 물(H2O)분자를 루이스 전자점식과 루이스 구조식으로 나타내 보자.
1. 탄소, 질소, 산소 원자의 홀전자 수는 각각 몇 개인가?
탄소 : 4개, 질소 : 3개, 산소 : 2개
2. 메테인, 암모니아, 물 분자에서 공유 전자쌍은 각각 몇 개인가?
메테인 분자 : 4개, 암모니아 분자 : 3개, 물 분자 : 2개
* 중심 원자 : 루이스 전자점식에서 C, N, O와 같이 다른 여러 개의 원자와 공유 결합을 형성하고 있는 원자들을 중심 원자라고 한다. 중심 원자는 옥텟 규칙을 만족시켜 모두 비활성 기체와 같은 전자 배치를 가지고 있다.
* 염화 수소의 루이스 전자점식과 루이스 구조식
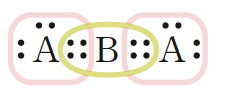
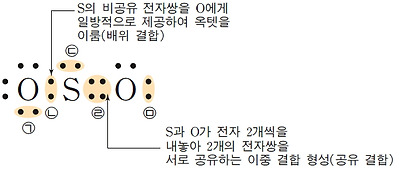
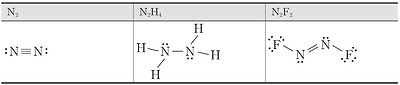
산소 원자는 원자가 전자가 6개이므로 옥텟 규칙을 만족시키려면 2개의 전자가 더 필요하다. 따라서 2개의 산소 원자가 결합하여 산소 분자를 형성할 때에는 2쌍의 전자를 공유해야 한다. 또한 질소 분자는 2개의 질소 원자가 3쌍의 전자를 공유해야 한다.
이와 같이 2개의 원자가 전자쌍 2개를 공유함으로써 이루어지는 결합을 이중 결합, 3개의 전자쌍을 공유함으로써 이루어지는 결합을 삼중 결합이라고 한다. 루이스 구조식을 나타낼 때에는 공유 전자쌍 1개당 1개의 선을 그어 표시한다.
* 이중 결합과 삼중 결합
이중 결합은 대부분 C, N, O, S원자가 형성하고, 삼중 결합은 대부분 C, N 원자가 형성한다. 질소 분자(N2)에서 질소 원자 사이의 결합은 단일 결합이 아닌 삼중 결합이다.
* 다원자 이온의 루이스 구조식
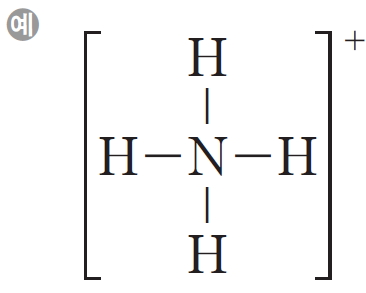
암모니아 분자는 질소 원자 1개가 수소 원자 3개와 각각 공유 결합을 하여 형성되었으며, 1쌍의 비공유 전자쌍을 포함하고 있고, 홀전자는 가지고 있지 않다. 따라서 암모니아 분자와 수소 이온이 만나면 질소 원자의 비공유 전자쌍을 수소 이온에 일방적으로 제공함으로써 질소 원자와 수소 원자 사이에 공유 결합이 형성되면서 암모늄 이온이 생성된다. 이와 같이 어떤 원자가 비공유 전자쌍을 일방적으로 제공하여 이루어지는 공유 결합을 배위 결합이라고 한다.
암모늄 이온에서 질소 원자는 일반적인 결합수보다 많은 4개의 결합을 가지고 있지만 여전히 옥텟 규칙을 만족시킨다. 질소, 산소, 인, 황과 같은 원자들은 종종 배위 결합을 형성한다.
삼플루오린화 붕소(BF3)와 같이 분자 중에는 옥텟 규칙을 만족시키지 못하는 것들이 있다. 이런 분자들은 전자를 얻어 여덟 전자를 이루려고 한다. BF3는 NH3에 있는 비공유 전자쌍을 일방적으로 제공 받아 옥텟 규칙을 만족시킬 수 있다. NH3의 N 원자는 전자쌍을 제공하여 BF3의 B 원자와 배위 결합을 형성한다.
* 배위 결합의 표시
배위 결합은 전자쌍을 일방적으로 제공한다는 것을 나타내기 위하여 화살표(→)로 결합선을 표시하기도 한다.
질산 암모늄은 NH4+과 NO3-으로 이루어진 이온 결합 물질이지만 각각의 이온들은 모두 다원자 이온으로서 원자 사이에 공유 결합과 배위 결합을 이루고 있어서 마치 하나의 단위인 것처럼 행동한다.
분자의 개념과 공유 결합
* 분자의 개념은 17세기부터 알려져 왔지만, 20세기에 공유 결합의 개념이 확립되면서 분자가 형성되는 원리를 좀더 정확하게 이해할 수 있게 되었다. 원자들이 원자가 전자를 공유하여 화학 결합을 한다는 것을 최초로 제안한 사람은 루이스(Lewis, G. : 1875~1946)이다.
공유 결합의 형성과 에너지
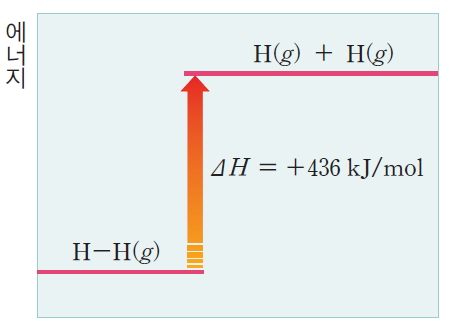
* 한 쌍의 수소 원자가 서로 결합하면 보다 안정한 에너지 상태의 수소 분자( H2 )를 형성하며 436 kJ/mol의 에너지를 방출한다.
* 반대로 수소 분자( H2 )를 2개의 수소 원자로 분리할 때 436 kJ/mol의 에너지를 가해 주어야 한다. 1몰의 결합을 끊는 데 필요한 에너지를 결합 해리 에너지(bond dissociation energy, D) 라고 부른다.
공유 결합 길이
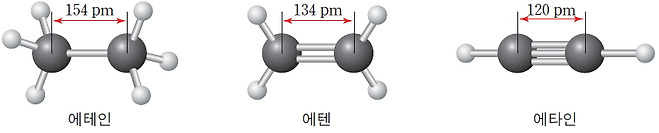
* 일반적으로 공유 결합을 형성하고 있는 원자 간 결합 에너지가 증가할수록 결합의 세기도 증가하며, 결합 길이가 짧아진다. 원자 사이에 다중 결합을 형성하는 경우에는 결합수가 많아질수록 결합 에너지는 증가하고, 공유 결합 길이는 짧아진다.
* 같은 원자 간 공유 결합의 경우 결합 길이와 결합 에너지는 두 원자 사이에 공유된 전자쌍을 나타내는 결합수에 따라 달라져 결합수가 증가하면 결합 길이는 감소하고, 결합 에너지는 증가한다.
관련문제
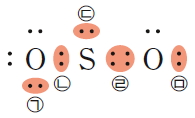
- 1. ㉠
- 2. ㉡
- 3. ㉢
- 4. ㉣
- 5. ㉤
- 정답
- 비공유 전자쌍 : 1개, 공유 전자쌍 : 3개
- 해설
- P은 15족 원소로서 원자가 전자 수가 5개이며, PF3에서 중심 원자가 된다. P은 F 원자 3개와 공유 결합을 형성하며, 1쌍의 비공유 전자쌍이 존재한다.
ㄴ. NH4+
ㄷ. H3O+
ㄹ. CH4
⑴ 입체 구조를 가지고 있는 물질을 모두 고르시오.
⑵ 중심 원자 주위의 결합각이 가장 큰 물질은 무엇인가?
- 정답
- ⑴ ㄴ, ㄷ, ㄹ
⑵ ㄱ - 해설
- ㄱ은 직선형, ㄴ은 정사면체형, ㄷ은 삼각뿔형, ㄹ은 정사면체형이다.
⑴ 정사면체형과 삼각뿔형의 분자 구조는 입체 구조이다.
⑵ 직선형 구조를 갖는 분자의 결합각은 180˘이므로, 결합각의 크기는 ㄷ 〈 ㄴ, ㄹ 〈 ㄱ이다.
⑴ 이온 결합 화합물을 고르시오.
⑵ 이중 결합을 가지고 있는 분자를 고르시오.
⑶ 삼중 결합을 가지고 있는 분자를 고르시오.
⑷ 쌍극자 모멘트 합이 0이 아닌 분자를 고르시오.
- 정답
- ⑴ MgO, CaF2
⑵ CO2
⑶ N2
⑷ NH3, H2O - 해설
- 공유 결합 화합물의 루이스 구조식은 다음과 같다.
⑴ 이온 결합은 금속 원소와 비금속 원소 사이에 형성된다. 따라서 주기율표 2족의 금속 원소인 Mg과 주기율표 16족의 비금속 원소인 O의 화합물 MgO과 주기율표 2족의 금속 원소인 Ca과 주기율표 17족의 비금속 원소인F의 화합물 CaF2은 이온 결합 화합물이다.
⑵ CO2에서 탄소 원자는 산소 원자 2개와 각각 이중 결합을 형성하고 있으며 직선형 구조를 이룬다.
⑶ N2 분자는 2개의 질소 원자가 삼중 결합을 형성하고 있으며 직선형 구조를 이룬다.
⑷ 공유 결합 화합물 중 NH3와 H2O은 쌍극자 모멘트 합이 0이 아니므로 극성 분자이다.
- 정답
- ⑴
⑵ 중심 원자인 N에서 공유 결합을 이루지 않은 전자가 NO2-은 2개, NO2는 1개, NO2+은 0개이다. 따라서 가장 크게 굽은형 구조를 이루는 NO2-의 결합각이 가장 작고, 직선형인 NO2+의 결합각이 가장 크다. - 해설
- ⑴ 질소는 원자가 전자가 5개, 산소는 원자가 전자가 6개이며, 루이스 구조식에 그려 주어야 하는 전자 총수는 NO2-의 경우 18개, NO2는 17개, NO2+은 16개이다.
⑵ 중심 원자 주위에 비공유 전자쌍이 존재하는 경우에 비공유 전자쌍과 다른 전자쌍 사이에 반발력이 크게 작용하게 되므로 결합각이 작아진다.
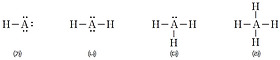
⑵ 위의 ㈎~㈑ 분자에 대하여 결합각을 비교하시오.
- 정답
- ⑴ ㈎ 직선형, ㈏ 굽은형, ㈐ 삼각뿔형, ㈑ 정사면체형
⑵ ㈏ < ㈐ < ㈑ < ㈎ - 해설
- ⑴ ㈎는 이원자 분자이므로 직선형 구조이다. ㈏, ㈐, ㈑는 중심 원자 주위의 전체 전자쌍 수가 4개로 같으며 정사면체형의 전자 배치를 갖지만, 비공유 전자쌍의 개수가 서로 다르므로 분자 구조에 차이가 난다. ㈏는 비공유 전자쌍이 2개 존재하므로 굽은형 구조이고, ㈐는 비공유 전자쌍이 1개이므로 삼각뿔형, ㈑는 공유 전자쌍만 4개이므로 정사면체형이다.
⑵ 직선형 구조를 갖는 ㈎는 결합각이 180˘이고, ㈏ ~ ㈑ 분자에서는 비공유 전자쌍이 많이 존재할수록 결합각이 감소한다. 따라서 결합각은 ㈏ < ㈐ < ㈑ < ㈎이다.
'사는 이야기 > 과학사전' 카테고리의 다른 글
| 태양풍이란? (0) | 2016.12.10 |
|---|---|
| 오르트 구름이란 무엇인가? (0) | 2016.12.10 |
| 금속결합(金屬結合) (0) | 2016.12.03 |
| 기상 현상과 에너지 (0) | 2016.12.03 |
| 빛에너지와 열에너지 (0) | 2016.12.03 |
![[그림 Ⅲ-20]수소 분자의 형성](http://t1.daumcdn.net/thumb/R659x0/?fname=http%3A%2F%2Ft1.daumcdn.net%2Fencyclop%2Fm24%2FIH7PmkgvBtB10YOd9uWrM4EZzMKmDpt9rOpn6sPM%3Ft%3D1441105821000)
![[그림 Ⅲ-21]물 분자의 형성](http://t1.daumcdn.net/thumb/R659x0/?fname=http%3A%2F%2Ft1.daumcdn.net%2Fencyclop%2Fm24%2FUI6ODNrqcSr5ALdXD84QQA01EgaLWJOpckPjNR1e%3Ft%3D1441105821000)
![[그림 Ⅲ-23]산소와 질소 분자의 형성과 루이스 전자점식 및 루이스 구조식](http://t1.daumcdn.net/thumb/R659x0/?fname=http%3A%2F%2Ft1.daumcdn.net%2Fencyclop%2Fm24%2Fq2lK8pOjlF6PsqKKWtR45yq0xPRaTy1KxolS3FNx%3Ft%3D1441105821000)
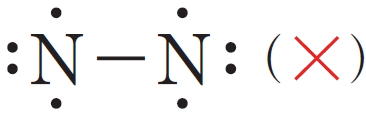
![[그림 Ⅲ-24]암모늄 이온의 생성 과정](http://t1.daumcdn.net/thumb/R659x0/?fname=http%3A%2F%2Ft1.daumcdn.net%2Fencyclop%2Fm24%2F6rQJs7JI0SmWRNjyI6QkdpGvxqptZYWdcZ53oMPs%3Ft%3D1441105821000)
![[그림 Ⅲ-25]배위 결합으로 형성된 삼플루오린화 붕소 암모늄](http://t1.daumcdn.net/thumb/R659x0/?fname=http%3A%2F%2Ft1.daumcdn.net%2Fencyclop%2Fm24%2FxfiERwYAccCvc4qBaYxaw6tcyBih6ydZuyjIRwDk%3Ft%3D1441105821000)
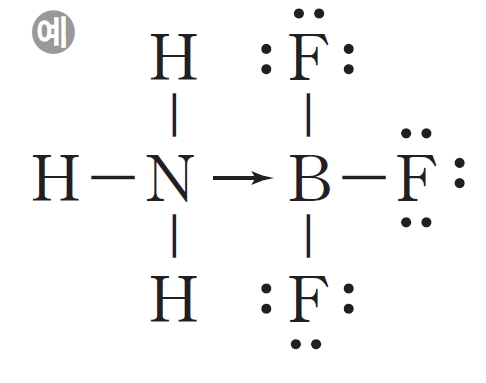
![[그림 Ⅲ-26]질산 암모늄](http://t1.daumcdn.net/thumb/R659x0/?fname=http%3A%2F%2Ft1.daumcdn.net%2Fencyclop%2Fm24%2F6r3QFMYUZVFPAf7CV6VSgLxNjKrTxmza1MQLFRyb%3Ft%3D1441105821000)