BTX
BTX는 방향족 화학제품인 벤젠(Benzene; B)∙톨루엔(Toluene; T)∙자일렌(Xylene; X)의 머리글자를 합하여 부르는 약칭이다. BTX는 합성섬유의 주요 원료로 쓰이는 등 그 쓰임새가 다양해지면서 중요한 화학공업의 한 분야로 자리잡았다.
1.벤젠
요약 1825년 마이클 패러데이가 고래기름으로 만든 조명용 가스에서 발견한 뒤, 1845년 독일의 화학자 A.W. 폰 호프만이 콜타르에서 검출했다. 주로 코크스로 가스에서 얻으며, 이 방법으로 가장 많이 시판되는 순도가 높은 벤졸을 만든다. 1950년부터 석유에서도 만들기 시작했다. 매우 유독하며 오랫동안 노출되면 백혈병을 일으킬 수 있다.
많은 화합물의 원료가 되는 벤젠은 에틸벤젠·페놀·말레산 무수물·아닐린·도데실벤젠·클로로벤젠 등을 만드는 데 사용된다. 벤젠은 잘 산화되지 않지만, 450℃에서 산화바나듐을 촉매로 산화시키면 벤조퀴논과 말레산 무수물이 얻어진다. 냄새가 특이한 무색투명한 액체로 80.1℃에서 끓고, 5.5℃에서 응고된다. 물에 약간 녹으며 고무, 지방, 여러 수지의 용매로 효과적이다.
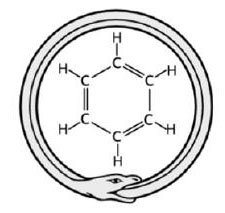
화학식은 C6H6이다. 1825년 마이클 패러데이가 고래기름으로 만든 조명용 가스에서 발견한 뒤, 1845년 독일의 화학자 A. W. 폰 호프만이 콜타르에서 검출해 벤젠이라 이름지었다. 주로 코크스로 가스에서 얻으며, 이 방법으로 가장 많이 시판되는 여러 등급의 순도(純度)가 높은 벤졸을 만든다.
1950년부터는 석유에서도 만들기 시작했다. 매우 유독하며 오랫동안 노출되면 백혈병을 일으킬 수도 있다.
벤젠 구조는 발견될 때부터 관심의 대상이었다. 1865년 독일 화학자 아우구스트 케쿨레는 단일결합과 이중결합이 교대로 있는 6각형 구조식을 제안했는데, 이 구조는 벤젠이 일반적인 이중결합이 보이는 특성을 나타내지 않을 뿐만 아니라 이중치환된 벤젠의 이성질체(異性質體) 수가 예상한 것보다 적다는 문제점에도 불구하고 아직까지 쓰이고 있다. 따라서 케쿨레는 자신이 제안한 벤젠의 6각형 구조에서 이중결합이 왔다갔다하며 진동하기 때문에 이성질체들의 고리 구조가 대칭성을 갖는다고 가정했다.
1931년 미국의 화학자 라이너스 폴링은 양자역학(量子力學)을 적용해 케쿨레가 평형을 이루고 있으리라 생각한 벤젠의 2가지 구조가 사실은 공명에 의해 하나의 혼성상태를 이루고 있다고 설명했다. 이 혼성상태에서는 고리 내의 탄소-탄소 결합이 보통의 이중결합과 단일결합의 중간 성질을 가질 것으로 예상되며, 따라서 벤젠의 반응성이 낮은 것에 대해 좋은 설명 근거가 된다(→ 벤젠고리). X선 자료는 이같은 설명을 뒷받침해주는데, 보통의 이중결합과 단일결합에서 탄소 사이의 거리는 각각 1.34Å과 1.54Å이나 벤젠 결합에서는 1.39Å이다. 분자 궤도함수도 비슷한 대칭구조를 보인다. 많은 화합물의 원료가 되는 벤젠은 에틸벤젠, 페놀, 말레산 무수물(플라스틱의 원료), 아닐린(염료의 원료), 도데실벤젠(세제의 원료)과 클로로벤젠(살충제의 원료) 등을 만드는 데 사용된다. 벤젠은 황산이나 질산과 반응해 단일·2중·3중 치환물을 만들며, 염소나 브롬과는 치환 또는 첨가 반응을 한다. 벤젠은 잘 산화되지 않지만, 450℃에서 산화바나듐을 촉매로 산화시키면 벤조퀴논과 말레산 무수물이 얻어진다. 180℃에서 수소와 니켈 존재하에 벤젠은 시클로헥산으로 환원되고, 적열관(赤熱管)을 통과하면 디페닐·디페닐벤젠·아세틸렌·수소를 생성한다. 냄새가 특이한 무색투명한 액체로 80.1℃에서 끓고, 5.5℃에서 응고된다. 물에 약간 녹으며 고무, 지방, 여러 수지(樹脂)의 용매로 효과적이다.
2.톨루엔
요약 공업용 화학약품을 제조하는 데 출발물질로 널리 사용되는 방향족 탄화수소.
메틸벤젠이라고도 함.
톨루엔(toluene)

화학식은 C6H5CH3이다. 콜타르 경유의 15~20%를 구성하며 석유의 부성분이다. 이들 두 물질은 상업용 톨루엔의 원료이지만 많은 양의 톨루엔은 석유 나프타의 접촉개질법으로 만든다. 톨루엔 화합물은 공업적으로 트리니트로톨루엔(TNT), 벤조산, 사카린, 염료, 사진용 약품 및 조제약 등의 합성에 사용되며, 항공기용 가솔린 용매와 노킹 방지용 첨가제로 사용된다. 순수한 톨루엔은 녹는점이 ―95℃, 끓는점이 110.6℃이고, 가연성·유독성 무색 액체로 물에 녹지 않지만 모든 일반적인 유기용매에 녹는다.
3.크실렌
요약 용매, 항공연료의 성분, 염료, 섬유, 필름 제조의 원료로 사용된다. 이 3가지 이성질체는 메틸기 위치에 따라 오르토, 메타, 파라로 분류된다.
콜타르 증류액과 석유에서 메타-크실렌이 50~60%, 오르토-크실렌과 파라-크실렌이 각각 20~25%인 혼합물로 얻어진다. 혼합물을 분별증류하여 끓는점이 비슷한 메타-이성질체와 파라-이성질체를 휘발성이 적은 오르토-이성질체와 분리한다. 메타-이성질체와 파라-이성질체의 혼합물을 냉각시키면 파라-크실렌이 거의 순수한 결정으로 얻어진다. 남아 있는 액체의 주요성분인 메타-이성질체는 플루오르화수소산과 삼플루오르화붕소 혼합물에 대한 용해도차를 이용해서 정제한다. 메타-크실렌과 파라-크실렌은 니트로화와 환원시키면 염료의 원료인 크실리딘이 된다.
크실렌(xylene)
자일렌 이성질체.
왼쪽부터 오른쪽으로 오쏘자일렌, 메타자일렌, 파라자일렌 구조 (자일렌=크실렌)

용매, 항공연료의 성분, 염료·섬유·필름 제조의 원료로 사용된다. 이 3가지 이성질체는 메틸기 위치에 따라 오르토(o)·메타(m)·파라(p)로 분류된다.
콜타르 증류액과 석유에서 m - 크실렌이 50~60%, o - 크실렌과 p - 크실렌이 각각 20~25%인 혼합물로 얻어진다. 혼합물을 분별증류하여 끓는점이 비슷한 m - 이성질체와 p -이성질체를 휘발성이 적은 o - 이성질체와 분리한다. m - 이성질체와 p - 이성질체의 혼합물을 냉각시키면 p - 크실렌이 거의 순수한 결정으로 얻어진다.
남아 있는 액체의 주요성분인 m - 이성질체는 플루오르화수소산과 삼플루오르화붕소 혼합물에 대한 용해도차를 이용해서 정제한다. m - 크실렌과 p - 크실렌은 니트로화와 환원시키면 염료의 원료인 크실리딘이 된다. 또한 m - 크실렌은 트리니트로 - t - 부틸 - m - 크실렌, 즉 향료의 성분인 크실렌 사향으로 전환될 수 있다.
크실렌을 산화시키면 모노카르복시산(톨루산)이 되었다가 디카르복시산(프탈산)이 된다. 상업적 크실렌 혼합물은 점성이 없는 가연성의 유독한 무색의 액체로 물에 녹지 않으나 여러 유기 용매와는 잘 섞인다. 보통 래커와 고무접착제의 용매로 쓰인다.
'사는 이야기 > 위험물기능장' 카테고리의 다른 글
| 메탄올-포름 알데히드-포름 산 (0) | 2021.02.07 |
|---|---|
| 이온화 경향 (0) | 2021.02.06 |
| 장뇌 (0) | 2021.02.03 |
| 염화칼슘[CaCl2] (0) | 2021.02.03 |
| 산화제와 환원제 (0) | 2021.02.03 |